
“中共肺炎”疫情正在快速蔓延,超过28个国家地区已证实确诊病例。(图片来源:Adobe stock)
【看中国2020年2月4日讯】2019新型冠状病毒肺炎(2019-nCoV,又称:中共肺炎)疫情正在快速蔓延,超过28个国家地区已证实确诊病例。英国牛津大学材料科学系博士秦才东向《看中国》投稿发表自己发现的遏止“中共肺炎”疫情一种新方法:通过主动增加体液碱性,中和冠状病毒刺突S蛋白上正电荷,使病毒失去方向和动力,使病毒无法识别和附着于带负电荷的细胞受体ACE2。
英国牛津大学材料科学系博士秦才东文章原文内容如下:
病毒感染过程中第一步是依靠静电吸引与细胞受体发生粘附结合。冠状病毒刺突蛋白携带正电荷,细胞受体ACE2带负电荷,才是感染发生的物理基础。中和刺突蛋白正电荷,应该是一种最经济、可以最快速解决当前病毒传染致病的方法。无需另外安排生产药剂,无需配置特别专业人士,无需增加医院病床。
注:ACE2携带负电荷可饱和,增加负离子浓度,不影响负电荷数,但可减少病毒所携带的正电荷数。
病毒感染的第一驱动力:阴、阳离子电荷之间的静电引力
抑制病毒感染的广谱方法:中和阳离子,屏蔽正电荷
病毒感染过程中的第一步是与细胞受体发生粘附结合,第二步才是特异性蛋白之间的选择性作用。病毒结合细胞受体主要是通过病毒吸附蛋白(VAPs)依靠静电吸附于细胞表面分子上。受体是病毒遇到的第一个细胞分子,若能对病毒的VAPs蛋白或受体进行屏蔽,病毒也就无法识别和附着宿主细胞表面,感染就不会实际发生。目前屏蔽VAPs蛋白和受体的方法,如李爱民、梁国栋所总结,是利用病毒受体模拟分子结合相应的病毒,以及利用病毒吸附蛋白VAPs模拟分子同受体结合,通过这种竞争性结合,阻断病毒的感染【李爱民、梁国栋,“病毒受体研究进展”,中华实验和临床病毒学杂志1997年第11卷第3期,299】。
赵清、李冬综述,如果找到病毒粘附蛋白VAPs以及病毒受体,就可以两面夹击,从两个方面阻断病毒与受体结合,一是封闭病毒的受体结合位点,另一方面可封闭受体,都可以阻断病毒与受体的结合,且环境的pH、离子对病毒吸附受体有影响【赵清、李冬,“病毒受体及其研究现状”,动物医学进展,2009,30(7):95-100】。
由于病毒没有能量和物质的独立制造系统,因此其与受体结合的唯一初始驱动力只是静电吸引,但因为尚缺少可以主动调节人体体液酸碱性的有效工具和手段,在病毒的预防和治疗方面,目前的技术方法都还没有涉及通过主动改变体液的酸碱性,来改变受体或配体携带电荷数量,达到屏蔽或部分屏蔽受体或配体电荷的方法。
当细胞受体带正电荷时,只能选择性的接受配体带负电荷的病毒,同理,当细胞受体带负电荷时,只能选择性的接受配体带正电荷的病毒。可以合理预期的是,如果能够主动调节病毒、细菌或细胞受体表面电荷性质和数量,那么病毒、细菌和细胞之间是否可以结合或结合的几率也随之可以调节。
病毒或细胞表面蛋白的电荷来源于氨基酸残基上氨基和羧基的水解反应,其中氨基可携带正电荷,羧基可携带负电荷。该反应受溶液的pH值影响,因此如果能够主动调节溶液(唾液、胃液或血液等体液)的pH值,就可以主动影响病毒、细胞表面电荷状态,以及相互之间的静电吸引力的大小。增加溶液的pH值,如果携带负电荷的氨基酸残基上仍有未解离的羧基,则将继续增加负电荷数,直至氨基酸残基上所有的羧基全部解离;如果氨基酸残基上的羧基已经全部解离或只有一个羧基,则增加pH值,不能再改变所携带负电荷的数量。增加pH值可以使携带正电荷的氨基酸残基上氨基所携带的正电荷逐步减少,即氨基上结合的氢离子H+逐步减少,直至携带电荷数为0(等电点),其后如能继续增加碱性,则开始使氨基酸残基上的羧基开始携带负电荷,负电荷的数量随着pH值的增加而增加,直至全部羧基解离。
对于携带正电荷的病毒,如SARS、MERS以及当前的2019-nCoV病毒,增加pH值,病毒携带的正电荷数逐步减少;对应的携带负电荷的受体电荷数或不变或逐步增加,根据受体上羧基数量而定。其结果是,配体和受体之间的静电吸引减弱直至消失。对配体或受体的实际屏蔽抑制效果依赖于pH值,依赖于剂量。
关于冠状病毒:病毒携带正电荷,受体ACE2携带负电荷
冠状病毒依靠刺突蛋白(S)与细胞结合达到入侵目的。SARS是用S蛋白与血管紧张素转换酶2(ACE2)结合入侵,中东呼吸综合症MERS则是S蛋白与二肽基肽酶4(DPP4)结合入侵。虽然SARS和2019-nCoV的S基因十分不同,但最后形成的S蛋白,折叠构型却几乎相同。2019-nCoV的S蛋白和ACE2进行模拟结合成功,可以推测2019-nCoV入侵细胞方法和SARS一样经由ACE2,所以入侵用的蛋白才会一样【Science China:Life Sciences,Letter to the Editor,在先发表,Xiantian Xu等,Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modelling of its spike protein for risk of human transmission,Jan.21,2020】。
SARS-CoV的S蛋白由含有1300aa的前体蛋白结合成,可以被宿主蛋白酶切割成氨基(N)末端S1亚基和羧基(C)末端S2亚基。其中,S1亚基含有受体结合域(RBD)结构域,可以与细胞表面的受体特异性结合,是决定细胞嗜性、宿主范围和动物传播的关键部分。而氨基末端(N)带正电荷决定了只有受体带负电荷的细胞才有被SARS-CoV感染的可能性。王新泉等研究报告表明,MERS-CoV的受体结合域RBD和受体DPP4通过分子表面形状和电荷的互补性相互作用【Cell Research,期刊在线,SARS冠状病毒刺突蛋白冷冻电镜结构揭示其受体结合的必需构象状态“,2016年12月23日】。后续研究表明,存在一个位于MERS-CoV刺突蛋白的N端结构域上的抗体中和表位【王新泉等,Nature Communications,”中东呼吸综合症冠状病毒刺突蛋白N端结构域上抗体中和表位的结构解析,2019年7月11日】。由此说明,MERS病毒刺突蛋白的表面是由可携带正电荷的N端氨基酸形成,对应的受体DPP4结合端类似如下所述的ACE2只能带负电荷。
上述关于SARS和MERS的结论是,两者的配体刺突蛋白向外的末端都是以带正电荷的N端与细胞受体粘附结合。可以推测,如同2019-nCoV病毒与SARS病毒的刺突蛋白的折叠构型几乎相同一样,两者的刺突蛋白都具有类似的末端带正电荷的N端结构。
ACE2作为羧肽酶,其催化活性受pH值和离子强度的影响【Tipnis SR等,J.Biol Chem,2000,275:33238-33243】,其机制之一应该是pH值的变化影响了ACE2携带电荷数量的变化。人类ACE2酶模型显示ACE2分子顶端的金属肽酶区域分为两个亚域,I和II,形成长而深的沟,深沟表面和周围的隆起带有很高的负电荷【Li W等,J.Nature,2003,426:450-454】。隆起线的负电荷与病毒的S蛋白配体的RBD的正电荷互补,使得病毒S蛋白与ACE2受体结合。
根据张玲的综合研究报告,SARS病毒蛋白受体结合区域的第487位苏氨酸是与人ACE2结合的关键位点,可与人ACE2上的第41位酪氨酸和第353位赖氨酸结合。因此推测,第41位酪氨酸(生理条件下带负电荷)也是与S蛋白RBD(带正电荷)结合的关键位点。按所述,第41位和第353位氨基酸与人一样的各类蝙蝠都可以被SARS-CoV感染。而皮氏菊头蝠可能主要是因为ACE2第41位氨基酸为组氨酸(生理条件下带正电荷)而非(带负电荷)的酪氨酸,从而不能通过皮氏菊头蝠侵染靶细胞【张玲,“蝙蝠ACE2与SARS-CoV S蛋白相互作用的关键氨基酸鉴别”,2010年黑龙江大学硕士学位论文】。或许正说明,因为S蛋白的RBD正电荷与组氨酸的正电荷互相排斥而不能发生接触和感染。由此也说明了,改变环境酸碱性可以影响带正电荷配体的冠状病毒与带负电荷受体的细胞的附着,从而达到对病毒感染的预防控制或治疗效果。
可以预期,通过主动增加体液碱性,也可以达到上述改变pH值或置换氨基酸改变酸碱性的效果。即,中和了冠状病毒刺突蛋白上的正电荷后,相当于使病毒失去了方向,失去了动力,病毒将无法识别和附着到带负电荷的细胞受体ACE2上。当然,实际效果需要临床验证。
实测唾液中负离子浓度可以30秒内增加1万倍,尿液中最高增加1000倍,血液中增加10倍,足以显著地降低病毒蛋白刺突上正电荷的数量,预期可以1小时内发挥疗效,且无毒无害无副作用,病人可以在家服用,减轻社会的医疗负荷。作为替代的试验之一,经颈部疱疹病毒涂抹试验,经常迁延复发的脓疱涂抹半小时后周边红色即开始消退,1天后脓疱开始结痂。
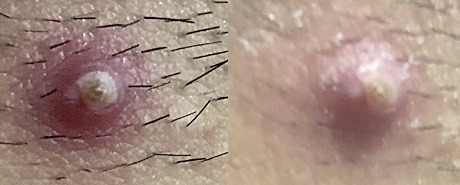
左图是涂抹前,右图是涂抹后半小时拍摄。(图片来源:秦才东提供)
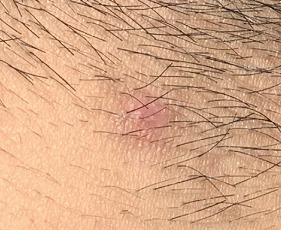
每天涂抹数次,上图是第7天拍摄。(图片来源:秦才东提供)
冠状病毒依靠刺突寻找靶细胞,中和了病毒刺突上的正电荷后,相当于使病毒失去了方向,失去了动力,病毒将无法识别和附着到带负电荷的细胞受体ACE2上。请见推特中的图片。
How does #2019nCoV #Coronavirus spread? Most likely by the virus being carried on a droplet of liquid (as from a sneeze or cough) or on a dust mote. Both substrates are usually big enough to be filtered out by a n95 mask (best fit tested) & maybe by a surgical mask (NOT as good!) pic.twitter.com/DDIFL2KNra
— 🇺🇸 DeplorabLynn ❌ (@LynnMagoo) February 1, 2020
2019新型冠状病毒(图片来源:CDC/公有领域)
马鞍山方程式环境科技有限公司
秦才东博士
2020年2月4日
(文章仅代表作者个人立场和观点)来源:看中国来稿
短网址: 版权所有,任何形式转载需本站授权许可。 严禁建立镜像网站.
【诚征荣誉会员】溪流能够汇成大海,小善可以成就大爱。我们向全球华人诚意征集万名荣誉会员:每位荣誉会员每年只需支付一份订阅费用,成为《看中国》网站的荣誉会员,就可以助力我们突破审查与封锁,向至少10000位中国大陆同胞奉上独立真实的关键资讯,在危难时刻向他们发出预警,救他们于大瘟疫与其它社会危难之中。










